Nature子刊:Phf6敲除可显著改善造血干细胞衰老表型
 2022-11-15
2022-11-15造血干细胞对于造血祖细胞和成熟血细胞的持续生成至关重要,造血干细胞的特点是高度的自我更新能力以及可分化成所有类型的血细胞,这也是维持机体长期健康和代谢更新的重要因素。
PHF6在淋巴和髓系白血病中观察到突变,并被报道为克隆造血的驱动因子。在一系列移植试验中,发现造血特异性Phf6缺失导致造血细胞自我更新增强。此外,PHF6主要定位于核仁,在核仁中参与核糖体生物发生的控制,并在双链DNA损伤部位促进DNA修复,这也表明PHF6在HSC衰老过程中或许发挥着重要作用。
2022年11月10日,来自美国哥伦比亚大学得科学家在Nature Aging 杂志发表题为“Epigenetic reversal of hematopoietic stem cell aging in Phf6-knockout mice”的文章,该文章发现Phf6是HSC衰老的重要表观遗传调节因子,Phf6敲除可显著改善造血干细胞衰老表型。

细胞外部刺激可刺激造血干细胞激活和细胞分裂,随着时间的推移,随之而来的是干细胞活性的损伤。在临床上造血干细胞老化导致免疫能力受损,感染风险增加,老年人患病率显著增加。
从机制上讲,年龄相关的HSC功能下降与氧化应激诱导的DNA损伤增加有关,但是表观遗传机制在HSC衰老中的作用尚不清楚。
为了确定Phf6敲除在造血衰老背景下的功能影响,研究人员对造血干细胞和祖细胞进行了单细胞RNA测序 ,分析年轻和老年野生型Phf6敲除小鼠的骨髓差异。发现早期的普通骨髓祖细胞与MPP2/MPP3 簇共享祖细胞标记基因的表达,但基于对骨髓谱系的转录程序与MPP细胞分离。值得注意的是,细胞周期特征显示HSC簇中的循环细胞(G1 期)数量较少,而MPP2/MPP3和MPP4组中的S期和G2/M 期细胞水平较高。总之该实验表明与年轻对照小鼠相比,老年小鼠HSC中Phf6表达上调。
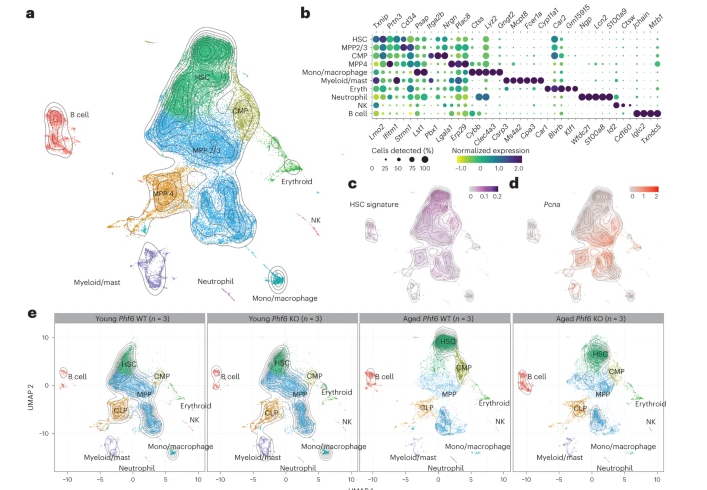
随后研究人员想知道Phf6缺失对老年造血系统的影响,评估了年轻(8 周大)和老年(21 至 24 个月大)小鼠HSPC隔室的免疫表型组成。发现年老的野生型小鼠与年轻小鼠相比,免疫表型定义的LT-HSCs的频率显著增加,但年老的Phf6敲除动物显示出LT-HSCs 的积累显著减少。此外,Phf6失活导致 MPP4 淋巴引发的祖细胞随着年龄的增长而显著减少,以支持保留的淋巴分化潜能。总之,这些结果表明老年Phf6野生型和Phf6敲除小鼠之间的HSC和祖细胞群存在显著的免疫表型差异,包括免疫表型定义的HSCs积累减少,祖细胞群的保存和老年HSC标志物的表面蛋白表达降低。

基因毒性应激和表观遗传改变被认为可以介导与年龄相关的造血干细胞再生和自我更新潜能的丧失。然而,这些变化背后的机制在很大程度上仍然未知。免疫表型、单细胞转录组分析和移植分析均显示,在老年小鼠phf6敲除的造血干细胞中,免疫表型定义的造血干细胞的积累显著减少,髓系偏向减少,造血重建能力增加,淋巴分化潜力保留,这些结果也表明Phf6是HSC衰老的重要表观遗传调控因子。



