Keratin是肾小管上皮细胞损伤的标志物
 2023-09-13
2023-09-13导读: 角蛋白(Keratin,K)是构成真核生物细胞骨架的主要成分,多在机体的上皮和间皮细胞表达,在生理或病理状态下,这些角蛋白在细胞的表达可以上调或下调,在特定情况下其异常表达是否与肾脏疾病相关?今天一起谈谈德国Aachen大学医学院的学者在《Kl: IF=18.998/Q1》上发表的这篇研究。

|
Question |
肾小管上皮细胞应激是进展性肾脏疾病中的常见现象,但目前对角蛋白(keratin,K)的表达和磷酸化作用知之甚少。 |
|
|
(1)健康小鼠肾组织中,K7、K8、K18和K19在集合管表达,K8、K18在肾小球壁层上皮细胞表达;(2)通过免疫组化、Western blot和qRT-PCR检测,在5种不同的肾小管损伤模型中,所有4种角蛋白在肾小管的表达增加了20-40倍,这种上调在疾病诱导后早期更为显著,并随着疾病进展而增加;(3)在应激下,K8和K18的磷酸化水平增加,在人类患者中,受损伤的肾小管也表现出角蛋白表达的增加。 |
|
|
所有4种主要的肾脏角蛋白在肾小管损伤时均在早期呈显著、进展性上调,并可能是肾小管细胞应激损伤时新的敏感标志物。 |
研究背景:
(1)肾小管上皮细胞损伤是肾纤维化的关键因素: 肾小管上皮细胞(TECs)是最丰富的、高度分化的肾脏细胞。TEC损伤在多种肾脏疾病中十分常见,也是疾病进展和肾纤维化发展的关键决定因素,TECs对应激反应敏感(如肾小管萎缩),这在几乎所有慢性肾病纤维化患者的肾活检中都能发现,这些变化包括上皮细胞功能丧失、间充质标志物的重新表达、细胞骨架的重塑等。
(2)什么是细胞角蛋白? 角蛋白是构成真核生物细胞骨架中间丝的最大亚群。在已知的54种人类角蛋白中,有24种是非毛发角蛋白,这些蛋白进一步细分为I型(K9-K28)和II型(K1-K8;K71-80)。角蛋白在上皮细胞中以特异性的方式表达,因此成为了病理学诊断良好的标志物,角蛋白作为细胞骨架,至少有一种I型和1种II型的角蛋白1:1表达于细胞中。他们位于细胞质内,并附着在上皮细胞连接处的细胞质上(称为桥粒)。角蛋白参与维持细胞的形状、机械稳定性、细胞运动和细胞内的组织运输,除了细胞骨架蛋白的作用之外,角蛋白还被认为是细胞应激蛋白,类似于应激诱导的热休克蛋白。
(3)角蛋白在肾脏疾病中的研究甚少: 角蛋白在很多疾病中表达上调,如皮肤病、癌症,以及在肝脏和胰腺损伤等多个动物模型。角蛋白突变与至少与60种不同的疾病有关,但除了将K7用于肾细胞癌亚型的病理诊断外,人们对它们在肾脏中的作用知之甚少。
(4)研究目的: 现有数据表明,在健康人肾脏中,主要表达K7、K8、K18和K19四种角蛋白。K8和K18在肾单位的所有上皮细胞中均有表达,包括Bowman囊的壁层上皮细胞,而K7和K19则定位于顶叶上皮细胞、髓袢细肢和集合管。在肾损伤过程中,角蛋白表达的调控在很大程度上是未知的,仅有的两项研究表明,角蛋白在损伤期间可能上调或下调,而且在动物模型中没有相关数据。本研究中,作者分析了角蛋白在健康和病变的小鼠肾脏以及人类肾活检组织中的表达和调控。
研究方案:
(1)UUO动物模型: 24只10周龄雄性C57BL6/N小鼠进行了UUO(单侧输尿管梗阻)建模。在UUO后的第1天(n=5)、第3天(n=4)、第5天(n=5)、第7天(n=5)和第10天(n=5)处死小鼠,获得肾组织(用于组织学评估、蛋白质和RNA分析)。
(2)腺嘌呤肾病动物模型: 12只10周龄的C57BL6/N雄性小鼠通过富含腺嘌呤的饮食诱导腺嘌呤肾病(补充0.25%腺嘌呤),小鼠在建模开始后第5天(n=4)、第14天(n=4)和第28天(n=4)处死小鼠。
(3)叶酸性肾病动物模型: 对8只10周龄雌性C57BL6/N小鼠每周进行叶酸静脉注射(250mg/kg,溶解于碳酸氢钠)诱导叶酸性肾病模型,8周后处死小鼠。
(4)UIRI动物模型: 对7只雄性FVB/N小鼠进行单侧缺血再灌注损伤,在缺血再灌注后第21天处死小鼠,获得缺血肾和健康对侧肾的肾组织进行分析。
(5)Alport小鼠模型: 6只雄性Col4a3-/-(Alport)小鼠和野生型同窝小鼠,均在Sv126背景下,分别在4周龄和8周龄时获取肾脏进行实验分析。
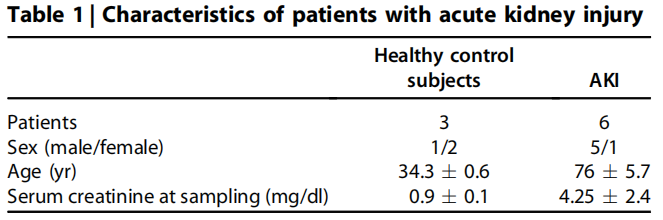
(6)人体肾组织和尿液: 本研究共纳入6例快速进展性肾小球肾炎、5例糖尿病性肾病、8例系统性红斑狼疮和9例多发性骨髓瘤患者。无任何其他肾脏疾病且组织病理学正常的肾细胞癌患者的肾远端肿瘤组织以及其他原因进行肾切除术的正常肾组织作为对照组(n = 5)。收集了3例健康志愿者和6例AKI2期或3期患者的尿液(详见Table 1),其中肾前性原因5例,肾后性原因1例。
(7)免疫组化和免疫荧光: 研究中使用的一、二抗列于Table 2,200放大后分别计算20个间质视野中每个组织中阳性染色面积的百分比(代表了整个皮质区域)。

此外,在选定的集合管的所有细胞中评估单细胞免疫组化表达,并对阴性对照受试者进行免疫组化 (Supplementary Figure S8),结果提示,在人、小鼠肾脏组织中均未检测到非特异性染色。

Figure S8.阴性对照受试者证实了角蛋白染色的特异性。 不管是在人还是动物模型中,(A, E) K8, (B, F) K18, (C, G) K7, and (D, H) K19均 未检测到非特异性染色。
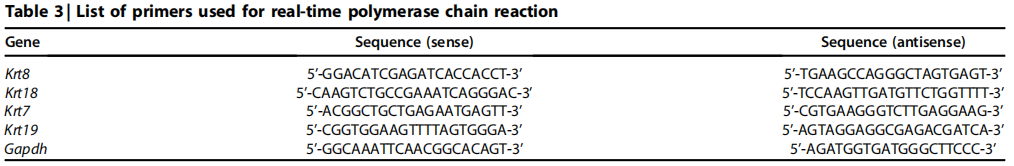
(8)RNA抽提和分析: 使用“RNeasy Mini Kit”从肾皮质中提取总RNA,总RNA中合成cDNA,并进行实时qRT-PCR,所用的引物和探针序列见Table 3。
(9)Western-blot: 对所有动物肾组织进行Western blot分析,每组取3只动物样本结果作为代表性结果。
(10)对多种人类肾脏疾病的肾活检组织的real-time PCR: 肾活检后,将组织转移到核糖核酸酶抑制剂中,并进行显微解剖肾小球和肾小管组织。从显微解剖的肾小球中进行总RNA分离,按流程进行逆转录和RT-PCR,采用标准曲线定量法分析mRNA的表达情况。
(11)公共数组分析: 使用GEO2R程序分析了5个阵列:GSE36496((UUO vs SHAM野生型) ,GSE35226(Tg26HIV转基因vs 野生型),GSE52004(IRI vs SHAM野生型),GSE642(糖尿病vs非糖尿病小鼠)和GSE19817(遗传性高血压vs正常血压)。
研究结果:
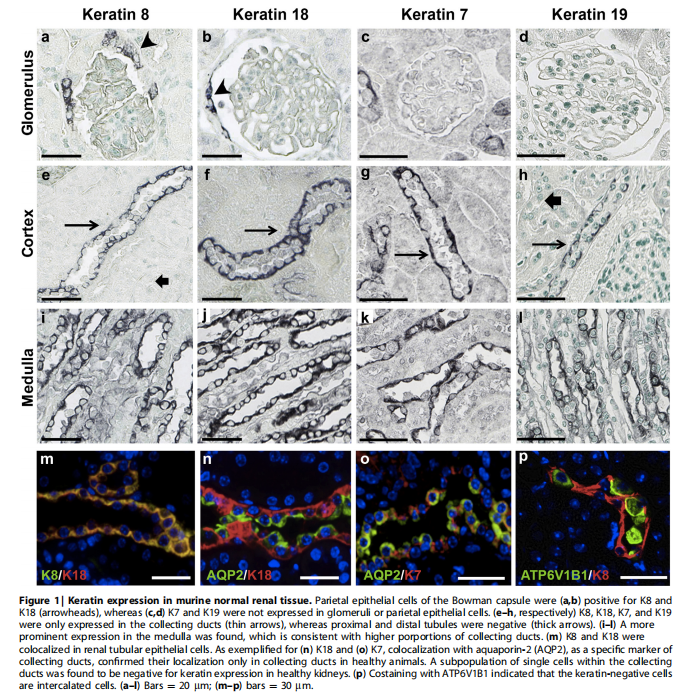
(1)角蛋白在健康小鼠肾脏中的表达: 在健康的肾小球中,壁层上皮细胞表达K8和K18,但与人肾组织相反,未发现K7或K19的表达 (Figure 1a–d)。在肾小管间质中,4种角蛋白的表达仅限于皮质和髓质集合管 (Figure 1e–l)。用集合管标记物水通道蛋白-2(AQP2)进行免疫荧光双染,证实了集合管中角蛋白的表达(Figure 1m–o)。在健康肾脏中,一种罕见的集合管内单细胞亚群角蛋白表达阴性,与ATP6V1B1双染表明,这些角蛋白阴性的细胞群是闰细胞(Figure 1p)。
(2)UUO中角蛋白的调控和细胞定位: 在UUO模型中分析了初期(D1、D3)、中期(D5、D7)、晚期(D10,伴有明显的肾小管萎缩和肾单位丢失)的不同时期角蛋白的调控作用。具有代表性的组织学表现证实了肾小管细胞损伤(Supplementary Figure S1)。
在UUO模型诱导损伤后的第一天,4种角蛋白在肾小管的表达均显著上调,并持续增加到第7天,角蛋白阳性区域的百分比增加了25倍(Figure 2a–j)。其表达主要见于集合管中,即使在疾病晚期(第10天),角蛋白的表达与对侧肾脏或早期阶段相比仍然明显上调。对单个肾小管细胞中角蛋白阳性面积的定量分析显示,与健康肾脏相比,UUO中角蛋白所占据的细胞质面积显著增加,表明在单个细胞中角蛋白的表达增加 (Figure 2k–o)。
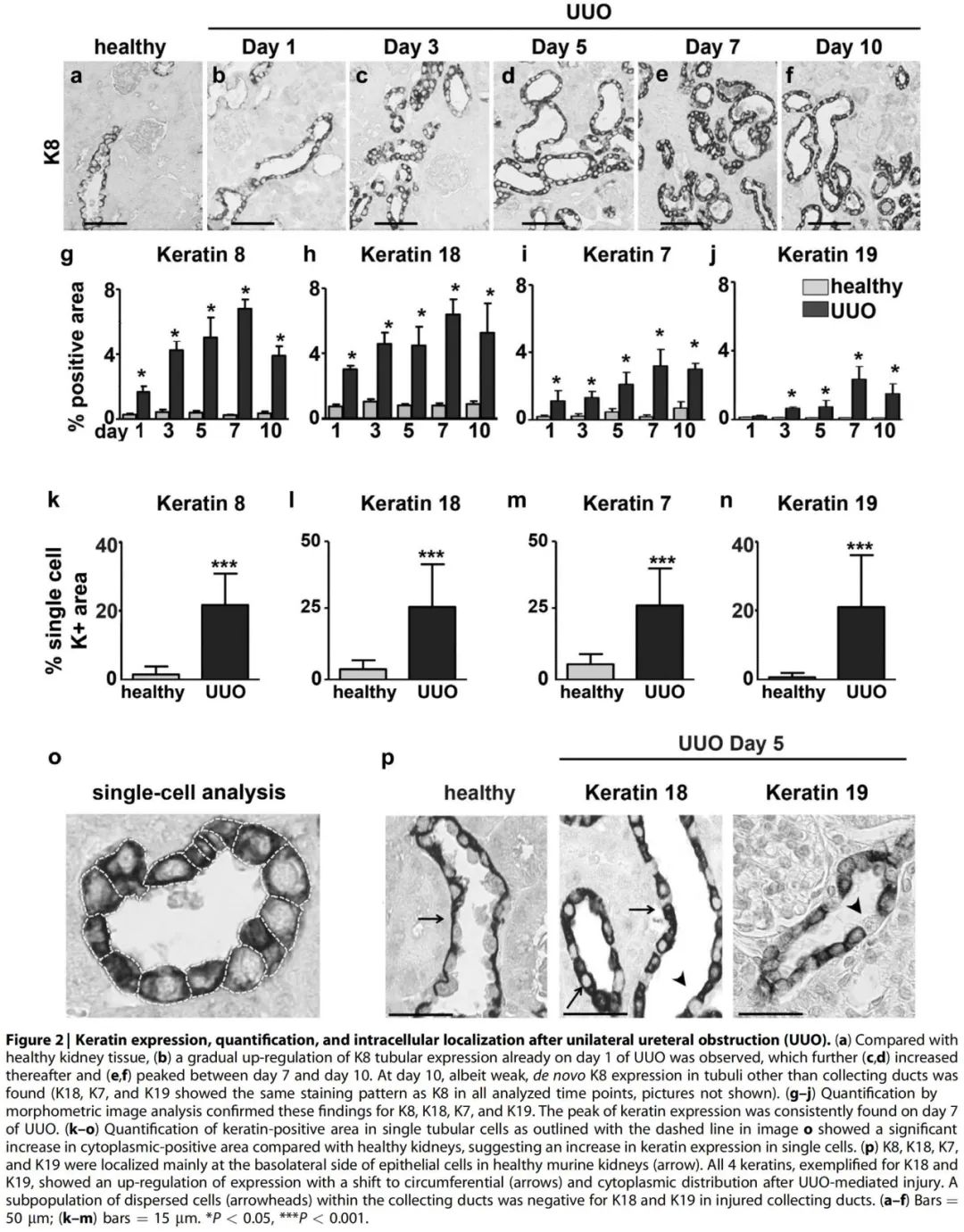
在健康小鼠肾组织中,所有的角蛋白主要定位于髓质肾小管细胞的基底外侧和皮质集合管的顶外侧(Figure 2p),在UUO的早期,角蛋白在肾小管上皮细胞中的定位变为圆周形表达(Figure 2p),集中在细胞质而非细胞核。用激光扫描显微镜证实了这种圆周形的定位 (Supplementary Figure S2)。

Figure S2. 共聚焦显微镜下K18免疫荧光染色。共聚焦激光扫描显微镜证实,与健康对照相比(A),K18(B)在UUO中表达显著上调并呈圆周形表达。
肾小管细胞损伤标志物NGAL (在健康肾脏中不表达,Figure 3a,) 的染色显示在损伤过程中,所有的NGAL+细胞都表达K18(Figure 3b,),但只有一部分K8+的细胞表达NGAL,用肾小管特异性标记物进行的免疫荧光染色证实了集合管中角蛋白的上调,虽然较弱,但在远端小管中也观察到部分表达(Figure 3c–h)。


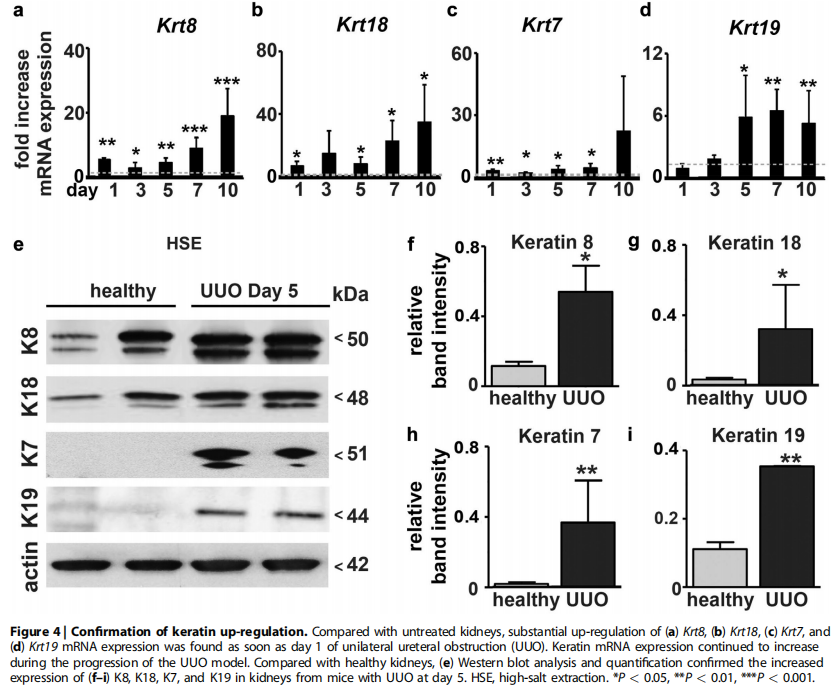
qRT-PCR分析显示,所有4种角蛋白均早期开始上调,并逐步上调最高40倍以上,与免疫组化得到的数据相似(Figure 4a-d),Western blot实验数据也进一步证实了所有4种角蛋白的上调高达30倍(Figure 4e–i)。
(3)在不同的肾脏疾病模型中角蛋白的调控: 在腺嘌呤肾病肾损伤模型中,分析了早期(第5天)、中期(第14天)和晚期(第28天)的不同时期的组织病变。与健康对照组相比,动物模型中通过免疫组化、qRT-PCR和Western blot等方法 (Supplementary Figure S3A–Q)显示所有的角蛋白在第5天即显著上调,并持续上升到第14天(增加了20倍),此后保持稳定 。
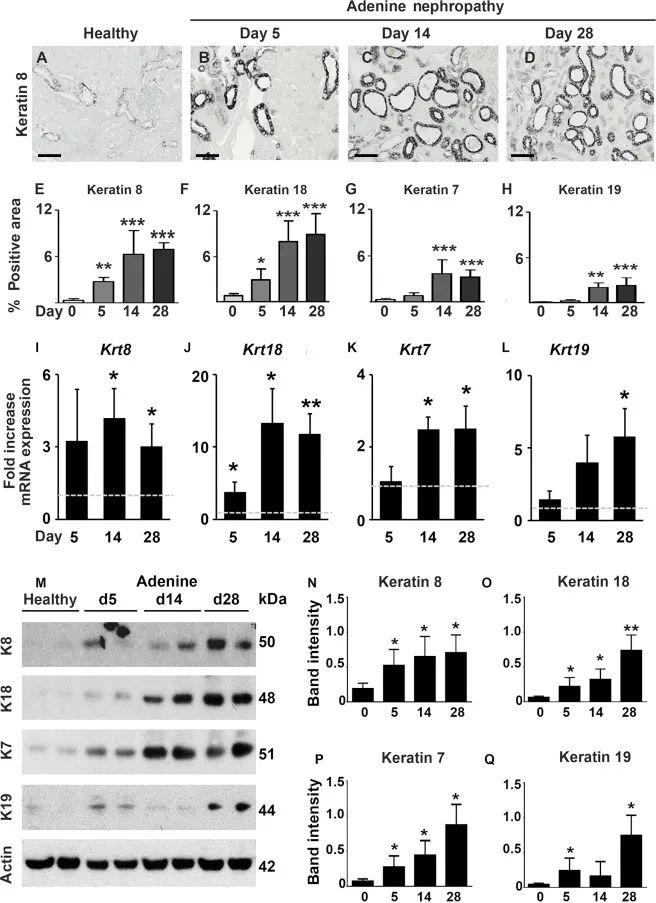
Figure S3. 在腺嘌呤肾病模型中,所有4种角蛋白的表达随时间逐渐增加。
单侧缺血再灌注损伤后21天,免疫组化提示肾小管中角蛋白表达也显著增加了4倍(Supplementary Figure S4A–H),并通过qRT-PCR和Western blot实验证实了这一结论 (Supplementary Figure S4I–Q)。
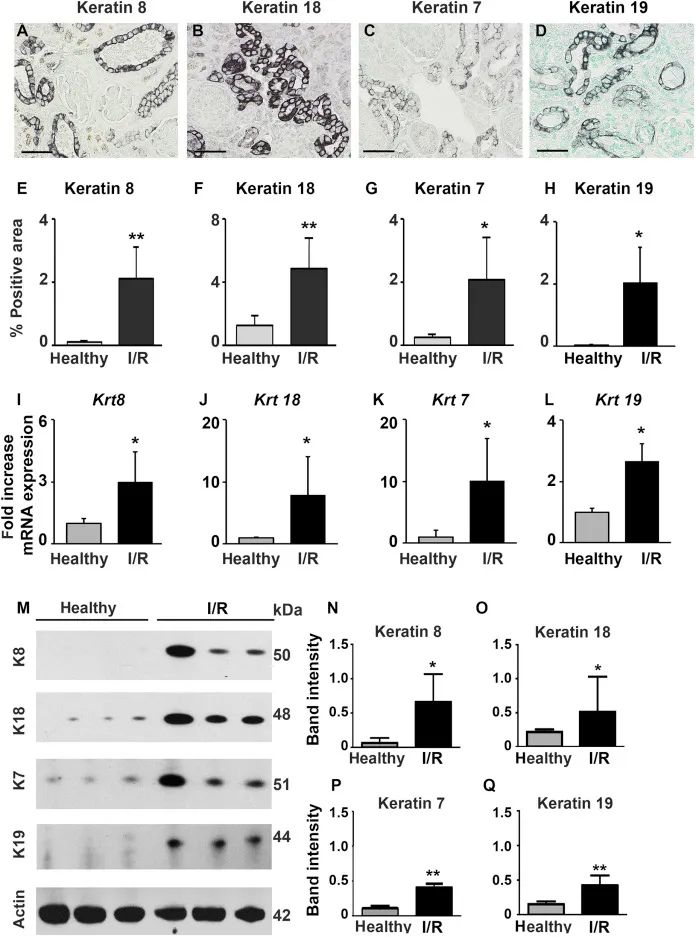
Figure S4. 角蛋白在小鼠UIRI模型中表达增加。
在中毒性肾小管损伤模型(即叶酸肾病)中,使用免疫组化、PCR或Western blot实验分析提示,与健康小鼠相比,病变肾脏中所有4种角蛋白的阳性染色面积显著增加了16倍 (Supplementary Figure S5A–L, Q–U),并且mRNA水平增加了10倍 (Figure S5M–P)。
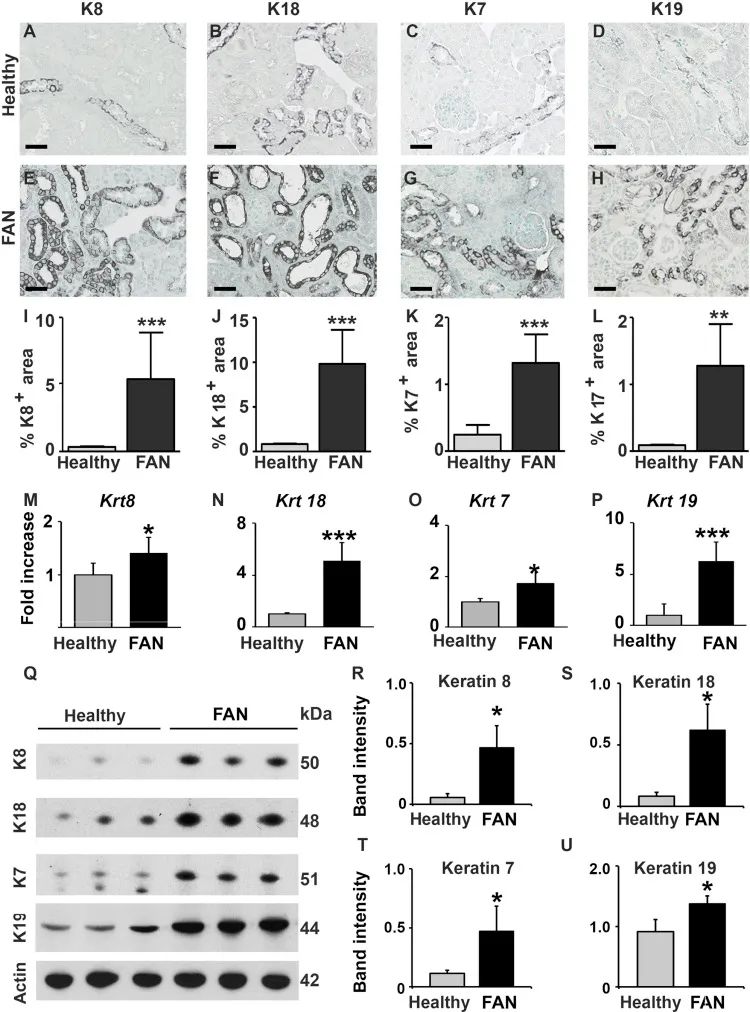
Figure S5. 小鼠叶酸性肾病(FAN)模型中角蛋白表达增加。
最后,作者分析了一个伴有蛋白尿的进行性肾小球肾炎和伴有纤维化的继发性肾小管间质损伤模型,即col4a3缺陷(Alport)小鼠模型。分析了Alport小鼠在4周时的早期阶段和在8周时的晚期阶段的角蛋白表达情况。在早期阶段,作者没有观察到任何明显的小管组织学损伤,也没有任何炎症或纤维化迹象 (Supplementary Figure S1),与此相一致的是,作者发现在这个阶段角蛋白仅略有增加,只有K7显示出显著增加(Supplementary Figure S6A–H)。
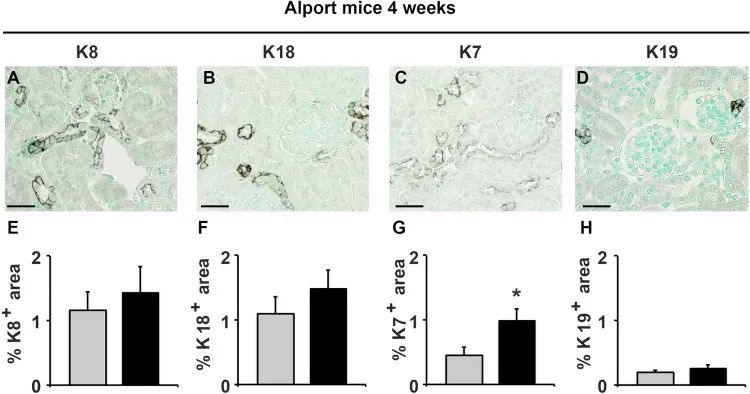
Figure S6. 4周龄Alport小鼠角蛋白表达轻微增加。
与上述所有动物模型结果一样,在显示明显肾小管损伤的晚期Alport小鼠中,所有4种角蛋白的表达均显著上调 (Figure 5a–u)。
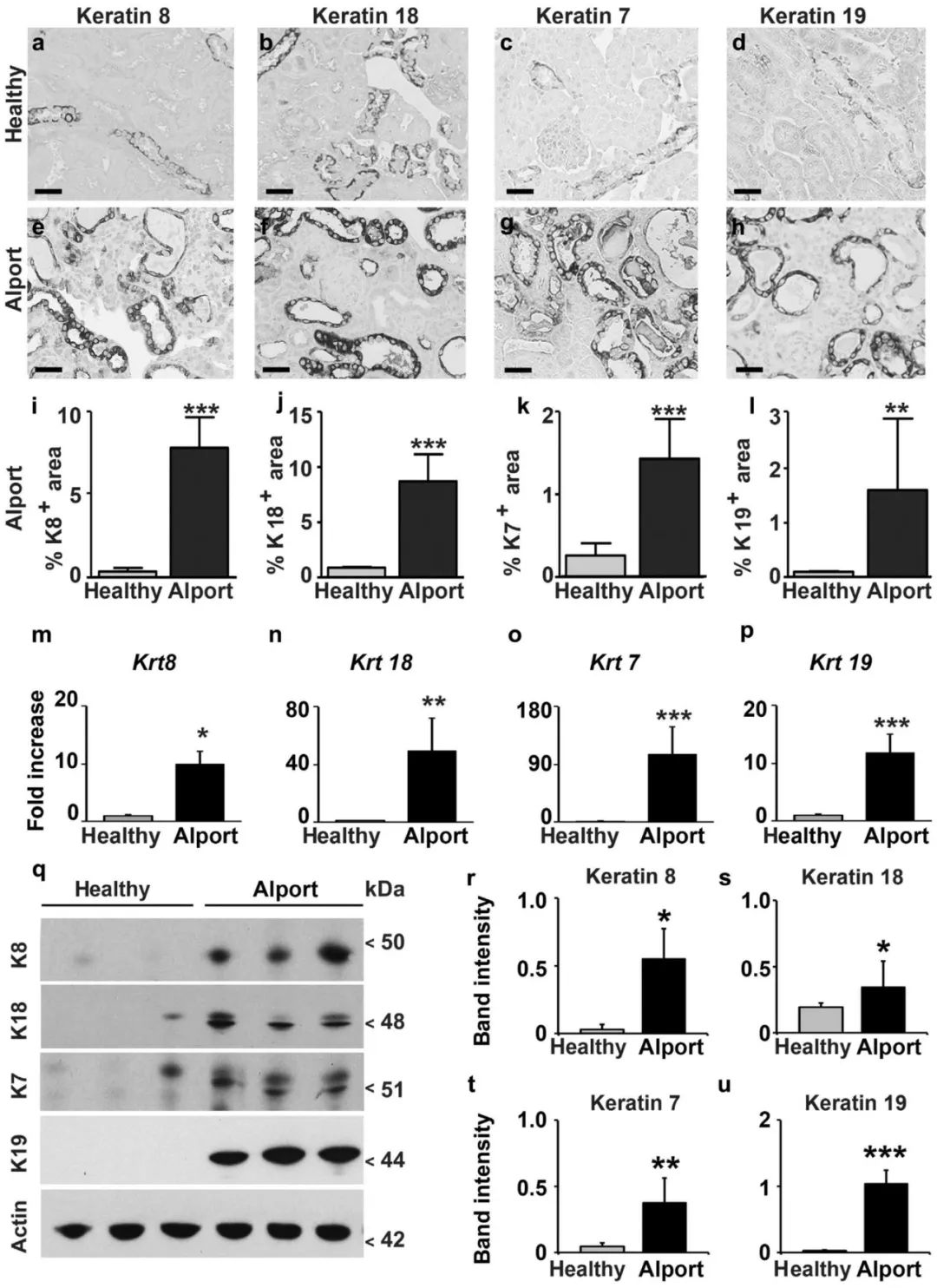

(4)对公开数据集中角蛋白表达的分析: 对现有微阵列数据的分析是以正常小鼠肾脏组织中显示的4种肾角蛋白为表达基础值,对比健康肾和不同肾脏疾病之间差异基因表达,分析显示在所有数据集中,疾病期间所有4种角蛋白均持续上调(Supplementary Figure S7)。

(5)角蛋白磷酸化水平: 为了分析角蛋白的磷酸化水平(翻译后修),一种丝氨酸-34磷酸化表位特异性角蛋白18(K18 pS34)的免疫荧光结果在健康肾脏中仅显示非常弱的磷酸化(Figure 6a–c),而在病变的UUO模型肾脏中观察到损伤小管的磷酸化显著增加 (Figure 6d–f)。有趣的是,一些小管细胞显示K18和磷酸化的K18有明显的共定位,而其他邻近的小管细胞几乎没有磷酸化(Figure 6d’–f’)。磷酸化水平的增加与初始损伤无关,在所有模型中都相似且显著 (Figure 6g–m)。在健康的肾脏中,K8(K8 pS74)的丝氨酸-74几乎没有磷酸化。损伤后,K8磷酸化水平增加,但与K18磷酸化相比不那么明显,只有少量分散的阳性细胞(Figure 6n–q)。

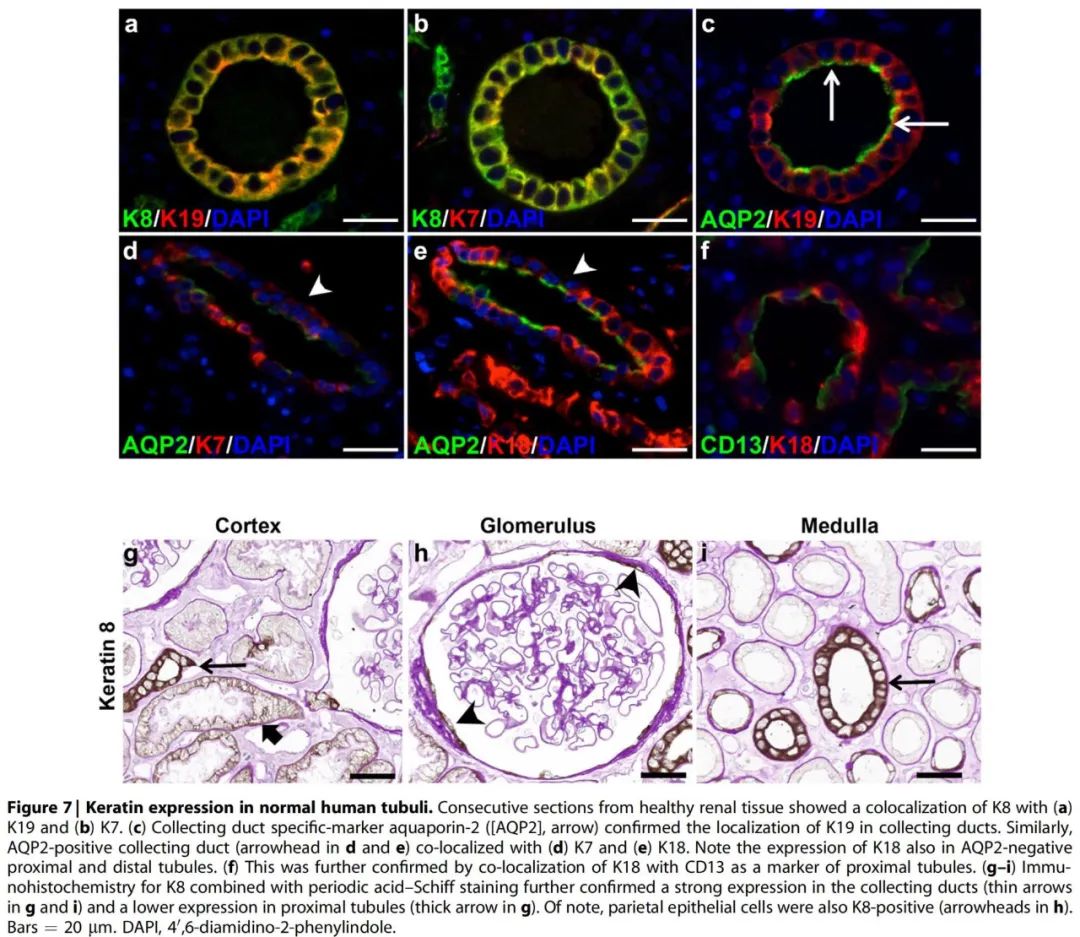
(6)角蛋白在正常人类肾脏中的表达: 作者的研究数据证实了在人类肾单位的所有肾小管细胞中均有K8和K18的表达,而K7和K19的表达受限。角蛋白之间可相互共定位(Figure 7a–c),并可在集合管与水通道蛋白-2共定位,提示K7和K19主要局限于集合管,而K8和K18在所有人肾小管节段中均被发现,Figure 7d–f显示了近端小管标记物CD13与K18共定位。K8的免疫组化和PAS染色进一步证实了这些发现(Figure 7g–i)。
(7)角蛋白在人类肾脏疾病中的表达: 作者分析了合并多发性骨髓瘤导致的原发性肾小管损伤(管型肾病、糖尿病性肾病、系统性红斑狼疮三种疾病的患者的肾活检的角蛋白表达情况,结果显示与健康对照组相比,这些患者的角蛋白阳性染色面积增加,其中管型肾病的增加最为显著(Figure 8q–t),得注意的是,管型的角蛋白染色也呈阳性(Figure 8m–p)。
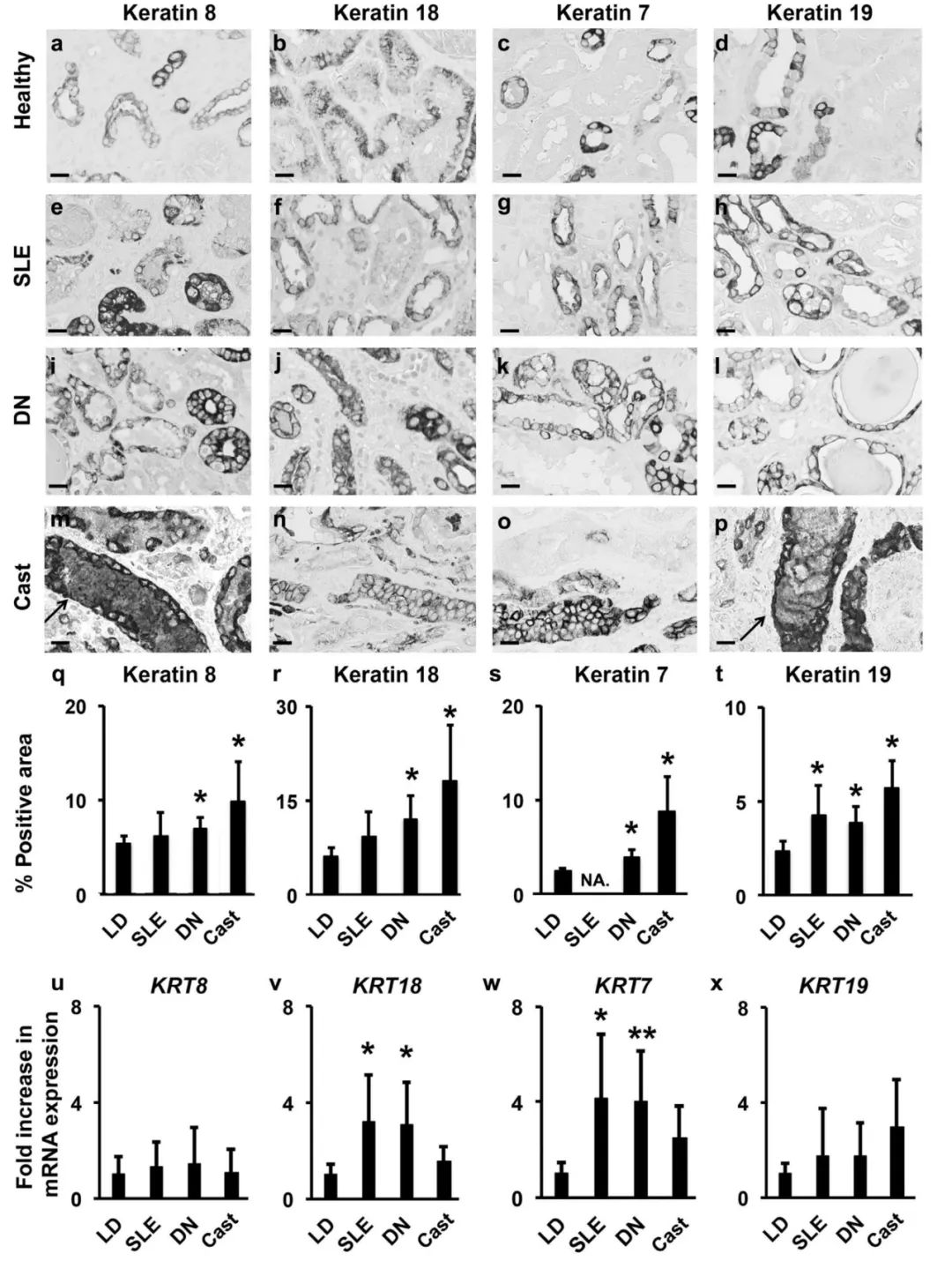

为了进一步证实这一发现,作者通过显微解剖分析了管型肾病、糖尿病性肾病、系统性红斑狼疮患者肾活检的皮质小管间质中角蛋白的mRNA表达,与健康供体移植肾组织相比,糖尿病性肾病和系统性红斑狼疮患者KRT7和KRT18显著升高。同时KRT8和KRT19的表达也呈增加趋势(Figure 8u–x)。
(8)角蛋白在顶叶上皮细胞中的表达: 在健康人肾小球中,鲍曼氏囊中的大多数顶叶上皮细胞中所有4种角蛋白均呈阳性(Figure 9a–d),新月体性肾炎患者表现出顶叶上皮细胞和新月体内细胞角蛋白阳性增加 (Figure 9e–h),新月体细胞K8和K18呈阳性,染色模式呈重叠现象,而这些细胞中只有一小部分K19呈阳性,K7则更少 (Figure 9e-h)。在Alport模型中也出现了细胞新月体,形成这些毛细血管外增殖病变的细胞显示了K8和18的强阳性,但K7和19染色呈阴性(Figure 9i–l)。

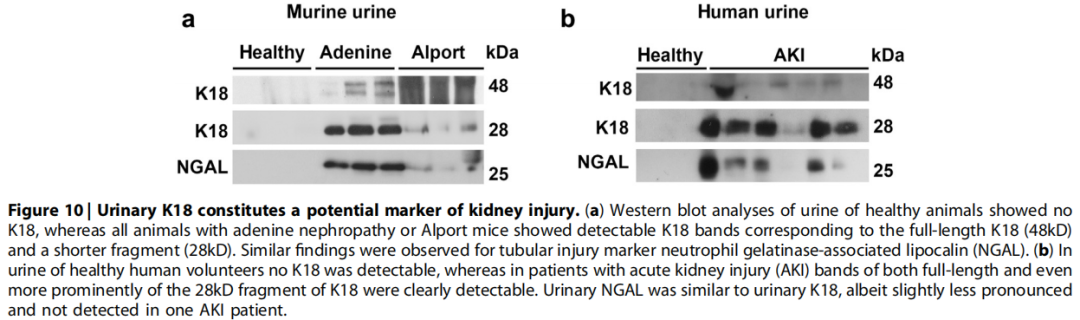
(9)尿角蛋白18: 为了评估角蛋白作为肾小管损伤标志物的潜力,作者使用Western blot分析了小鼠和肾损伤人尿液样本中的K18,在健康动物的尿液中,未检测到K18,而所有患有腺嘌呤肾病的动物或Alport小鼠均显示可检测到K18条带,全段的K18(48kD)和一个较短的片段(28kD),后者更为明显(Figure 10a),对已建立的肾小管损伤标志物NGAL也观察到类似的结果,但K18更突出,特别是28kD的片段。健康人尿液中没有检测到K18条带,而急性肾损伤患者显示了全段的K18和片段,28kD片段更明显,结果完全类似于小鼠的数据,而尿NGAL的表现则与尿K18相似。
研究总结:
(1)关键发现: 本研究的关键新发现是在疾病的早期角蛋白K7、K8、K18和K19在TEC损伤时均显著上调,并随疾病的进展表达水平逐渐增加, 因此,角蛋白可能是一种肾小管细胞应激时的非侵入性生物标志物。
(2)损伤早期标志物: 在UUO模型的第1天和腺嘌呤肾病模型的第5天,组织学上未观察到损伤或纤维化时,角蛋白即已高度上调,因此,角蛋白可能是TEC损伤的早期敏感标志物。随着肾损伤的进展,角蛋白的表达进一步增加,表明角蛋白上调的程度与损伤的程度相关。作者使用了不同的肾损伤动物模型模拟了不同的人肾脏疾病。在这些模型中,4种角蛋白一致上调,即使在疾病晚期仍处于高水平,并以明显的肾小管萎缩为特征。综上,角蛋白可能是肾小管损伤的早期敏感标志物。
(3)尿K18是肾小管损伤标志物: 本研究通过原发性和继发性肾小管损伤以及AKI患者的数据表明,尿K18可能是潜在和特异性肾小管细胞损伤标记物,与本研究类似,此前研究显示,与健康人相比,CKD3-5期患者的血清K18浓度升高,且在CKD5期患者尿液中也显著升高。事实上,血清K8、K18和K19是肿瘤和肝损的标志物,在肾脏疾病中的诊断价值仍需要研究进一步证实。
(4)角蛋白的转录调控尚不清楚: 研究显示NF-kB、肿瘤坏死因子-a和白细胞介素-6等被认为可能是角蛋白的调控因子并在肾脏疾病模型中表达上调,它们是否可能导致肾小管细胞损伤过程中角蛋白的上调,或者是否有其他因素参与仍有待进一步研究。
(5)第二个重要发现: 损伤后,角蛋白显示出细胞和细胞内定位的改变。生理条件下,角蛋白定位于集合管的基底外侧,损伤后转变为圆周形和胞质模式。在胰腺损伤时,K19和K20上调同时并入胞质纤维,治疗后恢复到典型的顶外侧向上分布。提示K8和K18优先定位于胞质纤维,而K7和K19主要定位于膜-近端顶外侧腔。
(6)第三个重要发现: 在肾脏损伤期间,角蛋白被高度磷酸化,至少在K18的丝氨酸-34处。同时在健康肾脏中几乎没有发现K8丝氨酸-74位点的磷酸化,而在各种肾小管损伤模型中都检测到(尽管没有K18那么突出)。角蛋白磷酸化可以激活细胞内信号转导通路,本研究发现K8和K18在各种应激损伤情况下发生了过度磷酸化。
(7)第四个重要发现: 肾小球炎时,角蛋白在肾小球壁层(顶叶)上皮细胞和新月体中表达上调,这种上调在小鼠和人类中都被发现。壁层上皮细胞是细胞新月体的主要组成部分,它们的激活导致了局灶性节段性肾小球硬化。本研究中,角蛋白只在顶叶上皮细胞表达,而在足细胞或肾小球毛细血管的任何细胞上不表达,形成新月体的大部分细胞都是K8和k18阳性细胞。有趣的是,在小鼠肾脏中,K7和K19既没有在顶叶上皮细胞中表达,也没有在新月体中表达。综上所述,角蛋白可能被用作毛细血管外增殖和壁层上皮细胞活化的标志物。
(8)动物模型与患者的肾小管损伤均与尿角蛋白增加有关: K8和K18在整个肾单位中都被发现,而在健康的小鼠中,它只在集合管中被发现。在小鼠和人类中,小管细胞K7和K19的表达相似,在应激期间所有4种角蛋白的上调也相似,作为人类肾小管应激的模型,作者分析了多发性骨髓瘤患者活检中角蛋白的表达,发现特别是在带有管型的小管中,角蛋白表达增加,这些管型本身的角蛋白表达也呈阳性,这表明从坏死的TECs中释放出来的角蛋白很可能是这些管型的一个组成部分。在糖尿病肾病和红斑狼疮患者的肾脏中,角蛋白也有所增加。更重要的是,在健康人的尿液中未检测到的K18,但急性肾损伤患者显示明显的K18条带,综上所述,与动物模型类似,患者的肾小管损伤也与尿角蛋白的增加有关。
(9)角蛋白应该被视为小管细胞中的应激反应蛋白: 驱动进展性肾脏疾病和纤维化的机制之一是上皮-间充质转化,在此期间,肾小管失去上皮细胞,获得间充质特征。角蛋白是上皮细胞的高度特异性标志物,它们的丢失被认为是上皮细胞向间质转化和慢性肾损伤的特征性,本研究表明了相反的情况,即受损伤的小管即使在疾病晚期也会出现角蛋白上调,以明显纤维化和小管萎缩为特征。因此,作者认为,角蛋白不应该被简单地视为上皮细胞标志物,与间充质标记物“相反”,如波形蛋白,而应该被视为小管细胞中的应激反应蛋白 。
(10)角蛋白在临床疾病中的功能需进一步研究: 角蛋白被证明是构成多种细胞的保护蛋白,虽然目前还没有关于肾脏的相关数据,目前,也只能推测角蛋白在肾脏疾病稳态中发挥功能作用。未来的研究应专注于分析角蛋白在肾小管再生、凋亡和机械稳定性中的作用,在各种肾脏疾病中强劲的上调表明了期肾保护作用,这与角蛋白作为应激诱导蛋白的作用相一致,在肝脏中也发现了类似的应激期间角蛋白的上调,如: K8和K18具有细胞保护功能,并确保了肝细胞的机械稳定性。K7、K8、K18和K19的表达、调控和潜在的诊断价值有得进一步研究,哪种特定的角蛋白在诊断方面表现最好尚待观察,但K18是最成熟的基于角蛋白的器官损伤标志物。



